miércoles, 12 de diciembre de 2012
Hidroxidos
Oxacidos
Sales
Catión
|
OH -
|
Nombre
| |
Ginebra
|
UIQPA
| ||
Li+
|
LiOH
|
Hidroxido Litioso
|
Hidroxido de Litio
|
Fe3+
|
FeOH3
|
Hidroxido Ferroso
|
Hidroxido de Hierro (III)
|
Ba2+
|
BaOH2
|
Hidroxido Barioso
|
Hidroxido de Bario (II)
|
Co3+
|
CoOH3
|
Hidroxido Cobaltoso
|
Hidroxido de Cobalto (III)
|
Mg2+
|
MgOH2
|
Hidroxido manesioso
|
Hidroxido de Magnesio (II)
|
Oxacidos
NOMBRE
|
FORMULA
|
NOMBRE
|
FORMULA
|
Ácido sulfúrico
|
HNO2
| ||
Ácido nítrico
|
HClO4
| ||
Ácido sulfuroso
|
H3PO4
| ||
Ácido carbónico
|
HBrO
| ||
Ácido Hipocloroso
|
H2SO4
|
Sales
NOMBRE
|
FORMULA
|
NOMBRE
|
FORMULA
|
Fluoruro de magnesio
|
CaCl2
| ||
Yoduro de potasio
|
LiF
| ||
Nitrito de sodio
|
NaClO
| ||
Hipobromito de calcio
|
NaHCO3
| ||
Sulfito acido de bario
|
CaHPO4
| ||
Fosfato de potasio
|
Ag2SO3
|
ENLACE COVALENTE
Un enlace covalente entre dos átomos o grupos de átomos se produce cuando estos, para alcanzar el octeto estable, comparten electrones del último nivel.1 La diferencia de electronegatividades entre los átomos no es suficiente
De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos o no metales.
El enlace covalente se presenta cuando dos átomos comparten electrones para estabilizar la unión.
A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro; en el enlace covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten uno o más electrones, es decir se unen a través de sus electrones en el último orbital, el cual depende del número atómico en cuestión. Entre los dos átomos pueden compartirse uno, dos o tres pares de electrones, lo cual dará lugar a la formación de un enlace simple, doble o triple respectivamente. En la representación de Lewis, estos enlaces pueden representarse por una pequeña línea entre los átomos.
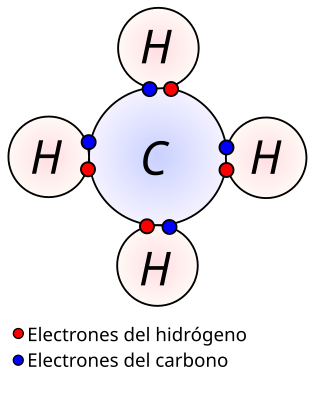
ENLACE IONICO
En Química, un enlace iónico o electrovalente es la unión de átomos que resulta de la presencia de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro. Gracias a esto se forma un compuesto quimico simple.
Dado que los elementos implicados tienen elevadas diferencias de electronegatividad, este enlace suele darse entre un compuesto metálico y uno no metálico. Se produce una transferencia electrónica total de un átomo a otro formándose iones de diferente signo. El metal dona uno o más electrones formando iones con carga positiva o cationes con una configuración electrónica estable. Estos electrones luego ingresan en el no metal, originando un ion cargado negativamente o anión, que también tiene configuración electrónica estable. Son estables pues ambos, según la regla del octeto o por la estructura de Lewis adquieren 8 electrones en su capa más exterior(capa de valencia), aunque ésto no es del todo cierto ya que contamos con dos excepciones, la del Hidrógeno (H) que se rodea tan sólo de 1 electron y el Boro (B) que se rodea de seis. La atracción electrostática entre los iones de carga opuesta causa que se unan y formen un compuesto.
ENLACE METÁLICO
Un enlace metálico es un enlace químico que mantiene unidos los átomos (unión entre núcleos atómicos y los electrones de valencia, que se juntan alrededor de éstos como una nube) de los metales entre sí.
Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de líneas tridimensionales que adquieren estructuras tales como: la típica de empaquetamiento compacto de esferas (hexagonal compacta), cúbica centrada en las caras o la cúbica centrada en el cuerpo.
En este tipo de estructura cada átomo metálico está dividido por otros doce átomos (seis en el mismo plano, tres por encima y tres por debajo). Además, debido a la bajaelectronegatividad que poseen los metales, los electrones de valencia son extraídos de sus orbitales. Este enlace sólo puede estar en sustancias en estado sólido.
Los metales poseen algunas propiedades características que los diferencian de los demás materiales. Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y tienen un punto de fusión alto.
El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes. Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica. Los metales generalmente presentan brillo y son maleables. Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes. Muchos de los metales tienen puntos de fusión más altos que otros elementos no metálicos, por lo que se puede inferir que hay enlaces más fuertes entre los distintos átomos que los componen. La vinculación metálica es no polar, apenas hay diferencia de electronegatividad entre los átomos que participan en la interacción de la vinculación (en los metales, elementales puros) o muy poca (en las aleaciones), y los electrones implicados en lo que constituye la interacción a través de la estructura cristalina del metal. El enlace metálico explica muchas características físicas de metales, tales comomaleabilidad, ductilidad, buenos en la conducción de calor y electricidad, y con brillo o lustre (devuelven la mayor parte de la energía lumínica que reciben).
La vinculación metálica es la atracción electrostática entre los átomos del metal o cationes y los electrones deslocalizados. Esta es la razón por la cual se puede explicar un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad.
Los átomos del metal tienen por lo menos un electrón de valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones. En lugar los niveles de energía externos de los átomos del metal se traslapan. Son como enlaces covalentes identificados.

YODO
*I1O-2---> I2O+H2O--->H2I2O2------------>HIO ac. hipoyodoso
*I3O-2--->I2O3+H2O-->H2I2O4------------>HIO2 ac. yodoso
*I5O-2--->I2O5+H2O-->H2I2O6------------>HIO3 ac. yodico
*I7O-2--->I2O7+H2O-->H2I2O8------------>HIO4 ac. peryodico
BROMO
*Br1O-2---> Br2O+H2O---->H2Br2O2----->HBrO ac. hipobromoso
*Br3O-2---> Br2O3+H2O-->H2Br2O4------>HBrO2 ac. bromoso
*Br5O-2---> Br2O5+H2O-->H2Br2O6------>HBrO3 ac. bromico
*Br7O-2--->Br2O7+H2O--->H2Br2O8------>HBrO4 ac. perbromico
H2SO3-Ac. sulfuroso (HSO3)-1 sulfito ac. (SO3)-2 sulfito
H2SO4-Ac. sulfurico (HSO4)-1 sulfato ac. (SO4)-2 sulfato
HNO2- Ac. nitroso (NO2)-1 nitrito ac.
HNO3- Ac. nitrico (NO3)-1 nitrato ac.
H3PO3- Ac. fosforoso (H2PO3)-1 fosforito ac. (PO3)-3 fosforito
H3PO4- Ac. fosforico (H2PO3)-1 fosfato ac. (PO3)-3 fosfato
H2CO3- Ac. carbonico (HCO3)-1 carbonato ac. (CO3)-3 carbonato
H3AsO3- Ac. arsenioso (H2AsO3)-1 arsenito ac. (AsO3)-3 arsenito
H3AsO4- Ac. arsenico (H3AsO4)-1 arsenato ac. (AsO4)-3 arsenato
HClO- Ac. hipocloroso (ClO)-1 hipoclorito ac.
HClO2- Ac. cloroso (ClO2)-1 clorito ac.
HClO3- Ac. clorico (ClO3)-1 clorato ac.
HClO4- Ac. perclorico (ClO4)-1 perclorato ac.
H2SO4-Ac. sulfurico (HSO4)-1 sulfato ac. (SO4)-2 sulfato
HNO2- Ac. nitroso (NO2)-1 nitrito ac.
HNO3- Ac. nitrico (NO3)-1 nitrato ac.
H3PO3- Ac. fosforoso (H2PO3)-1 fosforito ac. (PO3)-3 fosforito
H3PO4- Ac. fosforico (H2PO3)-1 fosfato ac. (PO3)-3 fosfato
H2CO3- Ac. carbonico (HCO3)-1 carbonato ac. (CO3)-3 carbonato
H3AsO3- Ac. arsenioso (H2AsO3)-1 arsenito ac. (AsO3)-3 arsenito
H3AsO4- Ac. arsenico (H3AsO4)-1 arsenato ac. (AsO4)-3 arsenato
HClO- Ac. hipocloroso (ClO)-1 hipoclorito ac.
HClO2- Ac. cloroso (ClO2)-1 clorito ac.
HClO3- Ac. clorico (ClO3)-1 clorato ac.
HClO4- Ac. perclorico (ClO4)-1 perclorato ac.
CONDUCCIÓN DE ELECTRICIDAD
Fabuloso. Reacciona con ligera espuma y brillo
alto.
Pinol. No tiene reacion en la sustancia y la luz es
muy baja.
Sal+agua. Produce luz muy baja.
Cloruro. No pasa nada.
Agua. En el agua la luz es fuerte.
Vinagre. Produce corriente baja y la luz es muy poca.
Materiales.
*Fabuloso *Foco
*Pinol *Soquet
*Cloruro de sodio *Clavijas
*Vinagre *Cinta de aislar
*Sal+agua
Procedimiento.
Se junta el soquet con la clavija punta a punta, siguientemente se conecta a la corriente y se prueba con las siguientes sustancias.
Fabuloso. Reacciona con ligera espuma y brillo
alto.
Pinol. No tiene reacion en la sustancia y la luz es
muy baja.
Sal+agua. Produce luz muy baja.
Cloruro. No pasa nada.
Agua. En el agua la luz es fuerte.
Vinagre. Produce corriente baja y la luz es muy poca.
HIDROXIDOS
HIDRACIDO ANIONES HIDRICO-URO BI= 1 HIDROGENO
*HCl.- ac. clorhidrico (Cl)-1 cloruro
*HBr.- ac. bromhidrico (Br)-1 bromuro
*HI.- ac. iodhidrico (I)-1 Iodruro
*HF.- ac. flourhidrico (F)-1 floruro
*H2S.- ac. slufhidrico (HS)-1 sulfuro ac. (S)-2 sulfuro
*H2Se.- ac. selenhidrico (HSe)-1 selenuro ac. (Se)-2 selenuro
*H2Te.- ac. telurhidrico (HTe) teluro ac. (Te)-2 telur
o
o
PRACTICA.- PRODUCCIÓN DE CO2
procedimiento.
Poner 3-5 ml. de H2O2 en el tubo de ensayo y adicione con pisca de MnO2, encienda el palillo con un cerillo una vez que se ponga rojo apagar e introducir en el tubo de ensayo con las sustancias adentro.
*El agua oxigenada con magnesio enciende poco la astilla, pero solo tapando la entrada del oxigeno al tubo.
*La pastilla de alk-selser provoca muchas burbujas ya que reacciono con agua.
*El oxido de sodio con el agua oxigenada, se pone en la abertura del tubo de ensayo el fuego y las sustancias reaccionan haciendo una pequeñisima explosion de tal forma que el tubo queda unos segundos encendidos.

procedimiento.
Poner 3-5 ml. de H2O2 en el tubo de ensayo y adicione con pisca de MnO2, encienda el palillo con un cerillo una vez que se ponga rojo apagar e introducir en el tubo de ensayo con las sustancias adentro.
*El agua oxigenada con magnesio enciende poco la astilla, pero solo tapando la entrada del oxigeno al tubo.
*La pastilla de alk-selser provoca muchas burbujas ya que reacciono con agua.
*El oxido de sodio con el agua oxigenada, se pone en la abertura del tubo de ensayo el fuego y las sustancias reaccionan haciendo una pequeñisima explosion de tal forma que el tubo queda unos segundos encendidos.

REGLA DEL OCTETO
La regla del octeto, enunciada en 1917 por Gilbert Newton Lewis, dice que la tendencia de los iones de los elementos delsistema periódico es completar sus últimos niveles de energía con una cantidad de 8 electrones de tal forma que adquiere una configuración muy estable. Esta configuración es semejante a la de un gas noble, los elementos ubicados al extremo derecho de la tabla periódica. Los gases nobles son elementos electroquímicamente estables, ya que cumplen con la estructura de Lewis, son inertes, es decir que es muy difícil que reaccionen con algún otro elemento. Esta regla es aplicable para la creación de enlaces entre los átomos, la naturaleza de estos enlaces determinará el comportamiento y las propiedades de las moléculas. Estas propiedades dependerán por tanto del tipo de enlace, del número de enlaces por átomo, y de las fuerzas intermoleculares.
Existen diferentes tipos de enlace químico, basados todos ellos, como se ha explicado antes en la estabilidad especial de la configuración electrónica de los gases nobles, tendiendo a rodearse de ocho electrónes en su nivel más externo. Este octeto electrónico puede ser adquirido por un átomo de diferentes maneras:

Las sales son compuestos que están formados en su estructura por un metal y un no metal...o por un metal, no metal y oxígeno.
PROPIEDADES DE LAS SALES
Las sales son substancias que tienen semejanza con el NaCl (sal de cocina).
Son sólidos, cristalinos, generalmente de color blanco.
Presentan sabor salado.
La mayoría son solubles en agua.
DIVISIÓN DE LAS SALES
Podemos dividir las oxisals en dos grupos: sales binarias o haloideas son aquellas que no contienen oxígeno, como el cloruro de sodio ( NaCl ) y oxisales si tienen oxígeno como el carbonato de calcio ( Ca2CO3)
CONCEPTO DE SALES BINARIAS
Son compuestos que están formados por metal y no metal.
Ejemplo:
NOMENCLATURA DE SALES BINARIAS
Para nombrar estas sales se escribe el nombre del no metal con la terminación URO, la preposición de (en caso de que sólo posea una valencia) y el nombre del metal.
| NaCl | CLORURO DE SODIO |
| MgHCl2 | CLORURO DE MAGNESIO |
| AlCl3 | CLORURO DE ALUMINIO |
Si el metal posee dos valencias, utilizar las terminaciones ICO para la mayor valencia y OSO para la menor valencia.
| FeCl3 | CLORURO FERRICO |
| FeCl2 | CLORURO FERROSO |
| CuCl2 | CLORURO CUPRICO |
| CuCl | CLORURO CUPROSO |
OBTENCIÓN DE SALES BINARIAS
Las sales binarias se obtienen al combinar un hidrácido con un hidróxido
| HIDRÓXIDO | + | HIDRÁCIDO | ----------> | SAL BINARIA | + | AGUA |
| NaOH | + | -------> | NaCl | + | H2O | |
| Mg(OH)2 | + | ----------> | MgCl2 | + | H2O |
EJEMPLO DE USOS DE SALES BINARIAS
El AgCl Cloruro de Plata se usa en la fabricación de película fotográfica.
El AgBr Bromuro de Plata que se usa también en fotografía.
El KI Yoduro de Potasio se utiliza como agregado en la sal de cocina para prevenir el Bocio.
El AgI Yoduro de Plata se usa para producir lluvia.
El SeS2 Disulfuro de Selenio se utliza en Shampoo para prevenir caspa.
El NaCl Cloruro de Sodio es la sal común o de mesa.

CONCEPTO DE OXISALES
Son compuestos que están formados por metal, no metal y oxígeno.
Ejemplo:
NOMENCLATURA DE OXISALES
Para nombrar estos compuestos se escribe el nombre del radical negativo con la terminación ATO para la mayor valencia del no metal de las dos que posee, y terminación ITO para la menor valencia del no metal de las dos que posee, seguida de la preposición de si posee una valencia y el nombre del metal ó con las terminaciones ya conocidas ICO para la mayor valencia y OSO para la menor valencia, si el metal posee dos valencias.
Ejemplo:
| Na2SO4 | SULFATO DE SODIO | (Azufre con valencia +6) |
| Na2SO3 | SULFITO DE SODIO | (Azufre con valencia +4) |
| Fe2(SO4)3 | SULFATO DE FERRICO | (Azufre con valencia +6) |
| FeSO3 | SULFITO DE FERROSO | (Azufre con valencia +4) |

OBTENCIÓN DE OXISALES
Las oxisales se obtienen al combinar un oxiácido con un hidróxido
| HIDRÓXIDO | + | OXIACIDO | ----------> | OXISAL | + | AGUA |
| NaOH | + | -------> | NaClO4 | + | H2O | |
| 2 NaOH | + | -------> | Na2SO4 | + | H2O |
EJEMPLO DE USOS DE OXISALES
NaHCO3 = Carbonato acido de Sodio, Bicarbonato de sodio. Se utiliza como efervecente para dolores de garganta.
El nitrato de sodio cuya fórmula química es NaNO3, es un agente preventivo de la enfermedad conocida como botulismo.
El nitrato de potasio sirve para limpiar pequeñas cantidades de metales no nobles e impurezas. Además forma parte esencial de la pólvora negra.
La cabeza de los cerillos contiene pequeñas cantidades de clorato de potasio.
El sulfato sódico, por ejemplo, se utiliza en la fabricación del vidrio, o como aditivo en los detergentes.
El carbonato cálcico forma parte de la formulación de las pastas dentales.
NaClO= Hipoclorito de sodio, es el desinfectante que usas en casa.

| Nomenclatura | |||
| Fórmula | Funcional | Stock | Estequiométrica |
| LiF | Fluoruro Lítico | Fluoruro de Litio | Fluoruro de Litio |
| CaF2 | Fluoruro Cálcico | Fluoruro de Calcio | Difluoruro de Calcio |
| AlCl3 | Cloruro Alumínico | Cloruro de Aluminio | Tricloruro de Aluminio |
| CuBr2 | Bromuro Cúprico | Bromuro de Cobre(II) | Dibromuro de Cobre |
| MnS | Sulfuro Manganoso | Sulfuro de Manganeso(II) | Sulfuro de Manganeso |
| CaTe | Telururo Cálcico | Telururo de Calcio | Telururo de Calcio |
| KI | Yoduro Potásico | Yoduro de Potasio | Yoduro de Potasio |
| FeCl2 | Cloruro Ferroso | Cloruro de Hierro(II) | Dicloruro de Hierro |
| NiS | Sulfuro Niqueloso | Sulfuro de Níquel(II) | Sulfuro de Níquel |
| K2Se | Seleniuro Potásico | Seleniuro de Potasio | Seleniuro de Dipotasio |
| PtF2 | Fluoruro Platinoso | Fluoruro de Platino(II) | Difluoruro de Platino |
| Au2S3 | Sulfuro aúrico | Sulfuro de oro(III) | Trisulfuro de Dioro |
SALES pag.173
SALES pag.173
sales binarias oxisales sales acidas
Na+1(Cl)-1 ->NaCl
Na(SO4)-2 -> Na2SO4 NaHCO3
k+1(Br)-1 ->
KBr Li(PO4)-3 ->Li3PO4 NaHS
Be+2(I)-1 ->BeI2 K(ClO)-1 -> KClO LiH2PO4
K2HPO4
CoHS
Suscribirse a:
Entradas (Atom)

